اسید سولفوریک – Sulfuric Acid
معرفی اسید سولفوریک
اسید سولفوریک ، ترکیب شیمیایی ، H2SO4 ، مایع بی رنگ ، بی بو ، بسیار خورنده ، روغنی. گاهی اوقات روغن ویترایول نامیده می شود.
تاریخچه اسید سولفوریک
اگرچه اسید سولفوریک در حال حاضر یکی از پرکاربردترین مواد شیمیایی است ، اما احتمالاً قبل از قرن شانزدهم این ماده کمی شناخته شده بود. توسط یوهان ون هلمونت (c.1600) با تقطیر مخرب ویترایول سبز (سولفات آهن) و سوزاندن گوگرد تهیه شد.
اولین تقاضای عمده صنعتی برای اسید سولفوریک ، فرآیند Leblanc برای تولید کربنات سدیم بود (تولید شده در حدود 1790).
اسید سولفوریک در Nordhausen از ویترایول سبز تولید شد اما گران بود. یک فرآیند برای سنتز آن با سوزاندن گوگرد با نمک سدیم (نیترات پتاسیم) اولین بار توسط یوهان گلاوبر در قرن هفدهم استفاده شد و توسط جوشوا وارد در انگلیس حدود 1740 به صورت تجاری توسعه یافت.
به زودی توسط فرآیند اتاق سرب ، که توسط جان روبوک در سال 1746 اختراع شد ، جایگزین شد و پس از آن توسط بسیاری دیگر بهبود یافت.
روند تماس در اصل توسط c.1830 توسط Peregrine Phillips در انگلستان توسعه داده شد. از آن کم استفاده می شد تا زمانی که نیاز به اسید غلیظ به خصوص برای تولید رنگ های آلی مصنوعی به وجود آمد
اسید سولفوریک غلیظ
با گرم شدن ، اسید 100٪ خالص گاز تری اکسید گوگرد ، SO3 را از دست می دهد تا جایی که یک محلول در حال جوشیدن ثابت یا آزوتروپ حاوی حدود 98.5٪ H2SO4در دمای 337 درجه سانتیگراد تشکیل شود.
اسید سولفوریک غلیظ یک اسید ضعیف است (اسیدها و بازها را ببینید) و یک الکترولیت ضعیف است زیرا نسبتاً کمی از آن در یونها در دمای اتاق جدا می شود.
هنگام سرما به راحتی با فلزات متداول مانند آهن یا مس واکنش نشان نمی دهد. هنگامی که گرم است یک ماده اکسید کننده است ، گوگرد موجود در آن کاهش می یابد.
گاز دی اکسید گوگرد ممکن است آزاد شود. اسید سولفوریک غلیظ داغ با اکثر فلزات و با چندین غیر فلز مانند گوگرد و کربن واکنش نشان می دهد.
از آنجا که اسید غلیظ دارای نقطه جوش نسبتاً بالایی است ، می توان از آن برای آزاد سازی اسیدهای فرار بیشتری از نمک آنها استفاده کرد ، به عنوان مثال ، وقتی کلرید سدیم (NaCl) یا نمک معمولی با اسید سولفوریک غلیظ ، گاز کلرید هیدروژن ، HCl گرم می شود تکامل یافته است.
اسید سولفوریک غلیظ تمایل بسیار زیادی به آب دارد. این ماده بعضاً به عنوان ماده خشک کننده استفاده می شود و می توان از آن برای کم آبی (حذف شیمیایی آب از) بسیاری از ترکیبات ، مانند کربوهیدرات ها ، استفاده کرد. این ماده با ساکارز قند ، C12H22O11 واکنش نشان می دهد ، یازده مولکول آب ، H2O را از هر مولکول ساکارز خارج می کند و یک توده سیاه اسفنجی شکننده از کربن و اسید سولفوریک رقیق باقی می گذارد. این اسید با پوست ، سلولز و سایر مواد گیاهی و حیوانی به طور مشابه واکنش می دهد.
وقتی اسید غلیظ با آب مخلوط می شود ، مقدار زیادی گرما آزاد می شود. می توان به یک باره گرمای کافی آزاد کرد تا آب جوشانده و اسید پاشیده شود.
برای رقیق سازی اسید ، اسید باید به آرامی با هم زدن مداوم به آب سرد اضافه شود تا تجمع گرما محدود شود. اسید سولفوریک با آب واکنش داده و هیدراتهایی با خصوصیات مشخص ایجاد می کند.
اسید سولفوریک را رقیق کنید
اسید سولفوریک رقیق یک اسید قوی و یک الکترولیت خوب است. این بسیار یونیزه است ، بسیاری از گرمای آزاد شده در رقت ناشی از هیدراتاسیون یون های هیدروژن است. اسید رقیق بیشترین خواص اسیدهای قوی رایج را دارد. به تورق آبی تبدیل می شود قرمز.
با بسیاری از فلزات واکنش نشان می دهد (به عنوان مثال ، با روی) ، باعث آزاد شدن گاز هیدروژن ، H2 و تشکیل سولفات فلز می شود.
با اکثر هیدروکسیدها و اکسیدها ، با برخی کربناتها و سولفیدها و برخی نمک ها واکنش نشان می دهد. از آنجا که دو پایه است (یعنی دو اتم هیدروژن قابل تعویض در هر مولکول دارد) ، هم سولفاتهای طبیعی (با هیدروژن جایگزین شده ، مثلا سولفات سدیم ، Na2SO4) و هم سولفاتهای اسیدی ، که سولفاتهای بی سولفات یا هیدروژن سولفات نیز نامیده می شوند (فقط یک هیدروژن جایگزین شد ، به عنوان مثال ، بی سولفات سدیم ، NaHSO4).
تولید اسید سولفوریک
برای تولید اسید سولفوریک دو فرآیند عمده (محفظه سرب و تماس) وجود دارد و در تعدادی درجه و غلظت از نظر تجاری در دسترس است. فرآیند محفظه سرب ، قدیمی تر از این دو فرآیند ، برای تولید بیشتر اسید مورد استفاده در ساخت کودها استفاده می شود.
اسید نسبتاً رقیق تولید می کند (62٪ 78٪ H2SO4). فرآیند تماس اسید خالص تر و غلیظ تری تولید می کند اما به مواد اولیه خالص و استفاده از کاتالیزورهای گران قیمت احتیاج دارد. در هر دو فرآیند دی اکسید گوگرد اکسید شده و در آب حل می شود.
دی اکسید گوگرد از طریق سوزاندن گوگرد ، از طریق سوزاندن پیریت ها (سولفیدهای آهن) ، از بو دادن معادن سولفید آهنی آماده برای ذوب یا سوزاندن گاز سولفید هیدروژن بدست می آید.
مقداری از اسید سولفوریک نیز از محلول های زباله سولفات آهن از آهن و فولاد ترشی و از لجن اسیدهای زائد پالایشگاه های روغن ساخته می شود.
در فرآیند محفظه سرب ، گاز دی اکسید گوگرد گرم وارد کف راکتور به نام برج Glover می شود و در آنجا با ویتریول نیتروژن شسته می شود (اسید سولفوریک با اکسید نیتریک ، NO و دی اکسید نیتروژن ، NO2 ، محلول در آن) و با اکسید نیتریک مخلوط می شود و گازهای دی اکسید نیتروژن مقداری از دی اکسید گوگرد به تری اکسید گوگرد اکسید می شود و در محلول شستشوی اسید حل می شود تا اسید برج یا اسید Glover (حدود 78٪ H2SO4) تشکیل شود.
از برج گلاور مخلوطی از گازها (شامل دی اکسید گوگرد و تری اکسید ، اکسیدهای نیتروژن ، نیتروژن ، اکسیژن و بخار) به محفظه ای با پوشش سرب منتقل می شود که در آنجا با آب بیشتری واکنش نشان می دهد. محفظه ممکن است یک اتاق بزرگ ، جعبه مانند یا یک محفظه به شکل یک مخروط کوتاه باشد.
اسید سولفوریک با یک سری واکنشهای پیچیده تشکیل می شود. روی دیواره ها متراکم شده و در کف محفظه جمع می شود. ممکن است از سه تا دوازده اتاق در یک مجموعه وجود داشته باشد. گازها پشت سر هم از هر کدام عبور می کنند.
اسید تولید شده در محفظه ها که اغلب به آنها اسید محفظه یا اسید کود گفته می شود ، حاوی 62٪ تا 68٪ H2SO4 است. پس از عبور گازها از محفظه ها ، آنها به راكتوري به نام برج Gay-Lussac منتقل مي شوند و در آنجا با اسيد غليظ خنك شده (از برج Glover) شسته مي شوند.
اکسیدهای نیتروژن و دی اکسید گوگرد واکنش داده نشده در اسید حل می شوند و ماده نیتروژنی مورد استفاده در برج Glover را تشکیل می دهند. گازهای زائد باقیمانده معمولاً در جو تخلیه می شوند.
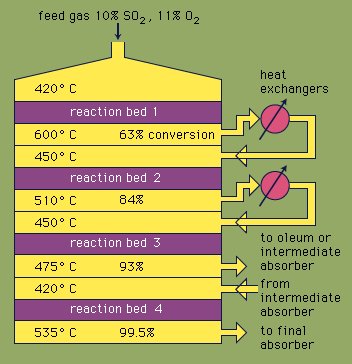
در فرآیند تماس ، دی اکسید گوگرد خالص و هوا مخلوط می شوند ، تا حدود 450 درجه سانتیگراد گرم می شوند و از یک کاتالیزور عبور می کنند.
دی اکسید گوگرد به تری اکسید گوگرد اکسید می شود. کاتالیزور معمولاً پلاتین روی حامل سیلیس یا آزبست یا پنتا اکسید وانادیوم روی حامل سیلیس است.
تری اکسید گوگرد خنک می شود و از دو برج عبور می کند. در برج اول آن را با اولئوم (اسید سولفوریک بخور ، اسید سولفوریک 100٪ با تری اکسید گوگرد محلول در آن) شستشو می دهند.
در برج دوم با 97٪ اسید سولفوریک شسته می شود. 98٪ اسید سولفوریک معمولاً در این برج تولید می شود. گازهای زائد معمولاً در جو تخلیه می شوند. اسید از هر غلظت دلخواه ممکن است با مخلوط کردن یا رقیق کردن محصولات این فرآیند تولید شود.
موارد استفاده از اسید سولفوریک
اسید سولفوریک یکی از مهمترین مواد شیمیایی صنعتی است. هر سال بیشتر از هر ماده شیمیایی تولید شده دیگر ساخته می شود.
بیش از 40 میلیون تن از آن در سال 1990 در ایالات متحده تولید شده است. این کشور دارای کاربردهای متنوعی است و بخشی از آن را در تولید تقریباً تمام کالاهای تولید شده ایفا می کند. بیشترین کاربرد اسید سولفوریک در تولید کودها ، به عنوان مثال ، سوپرفسفات آهک و سولفات آمونیوم است.
این ماده به طور گسترده ای در ساخت مواد شیمیایی ، به عنوان مثال ، در ساخت اسید کلریدریک ، اسید نیتریک ، نمک های سولفات ، مواد شوینده مصنوعی ، رنگ ها و رنگدانه ها ، مواد منفجره و داروها استفاده می شود.
از این ماده در تصفیه نفت برای شستشوی ناخالصی های بنزین و سایر محصولات پالایشگاهی استفاده می شود. اسید سولفوریک در فرآوری فلزات ، به عنوان مثال ، در ترشی (تمیز کردن) آهن و فولاد قبل از آبکاری آنها با قلع یا روی ، استفاده می شود.
ریون با اسید سولفوریک ساخته می شود. این به عنوان الکترولیت در باتری ذخیره اسید سرب است که معمولاً در وسایل نقلیه موتوری استفاده می شود (اسید برای این استفاده ، حاوی حدود 33٪ H2SO4 و با وزن مخصوص حدود 1.25 ، که اغلب اسید باتری نامیده می شود).
برای خرید اسید سولفوریک اینجا را کلیک کنید
ترکیب شیمیایی
سولفوریک همچنین هجی سولفوریک (H2SO4) است که به آن روغن ویتریول یا سولفات هیدروژن ، مایع متراکم ، بی رنگ ، روغنی و خورنده نیز می گویند.
یکی از مهمترین تجارات تجاری در بین کلیه مواد شیمیایی. اسید سولفوریک به صورت صنعتی و با واکنش آب با تری اکسید گوگرد تهیه می شود ، که به نوبه خود توسط ترکیب شیمیایی دی اکسید گوگرد و اکسیژن یا توسط فرایند تماس یا فرآیند محفظه ساخته می شود.
در غلظت های مختلف این اسید در ساخت کودها ، رنگدانه ها ، رنگ ها ، داروها ، مواد منفجره ، مواد شوینده و نمک ها و اسیدهای غیر آلی و همچنین فرآیندهای تصفیه نفت و متالورژی استفاده می شود.
اسید سولفوریک در یکی از آشناترین کاربردهای خود به عنوان الکترولیت در باتری های ذخیره سرب – اسید عمل می کند.
اسید سولفوریک خالص دارای وزن مخصوص 1.830 در دمای 25 درجه سانتیگراد (77 درجه فارنهایت) است. در 10.37 درجه سانتیگراد (50.7 درجه فارنهایت) منجمد می شود.
با گرم شدن ، اسید خالص تا حدی به آب و تری اکسید گوگرد تجزیه می شود. دومی به عنوان بخار فرار می کند تا زمانی که غلظت اسید به 98.3 درصد کاهش یابد.
این مخلوط اسید سولفوریک و آب در دمای ثابت 338 درجه سانتیگراد (640 درجه فارنهایت) در یک فشار جو می جوشد. اسید سولفوریک معمولاً با غلظت 78 ، 93 یا 98 درصد تأمین می شود.
به دلیل تمایل به آب ، اسید سولفوریک بی آب خالص در طبیعت وجود ندارد. فعالیت آتشفشانی بسته به میزان انتشار مربوط به آتشفشان های خاص می تواند منجر به تولید اسید سولفوریک شود و آئروسل های اسید سولفوریک حاصل از فوران می توانند سال ها در استراتوسفر باقی بمانند.
سپس این آئروسل ها می توانند به دی اکسید گوگرد (SO2) ، تشکیل دهنده باران اسیدی تبدیل شوند ، اگرچه فعالیت های آتشفشانی یک عامل نسبتاً جزئی در بارندگی های اسیدی است.
چرخه گوگرد
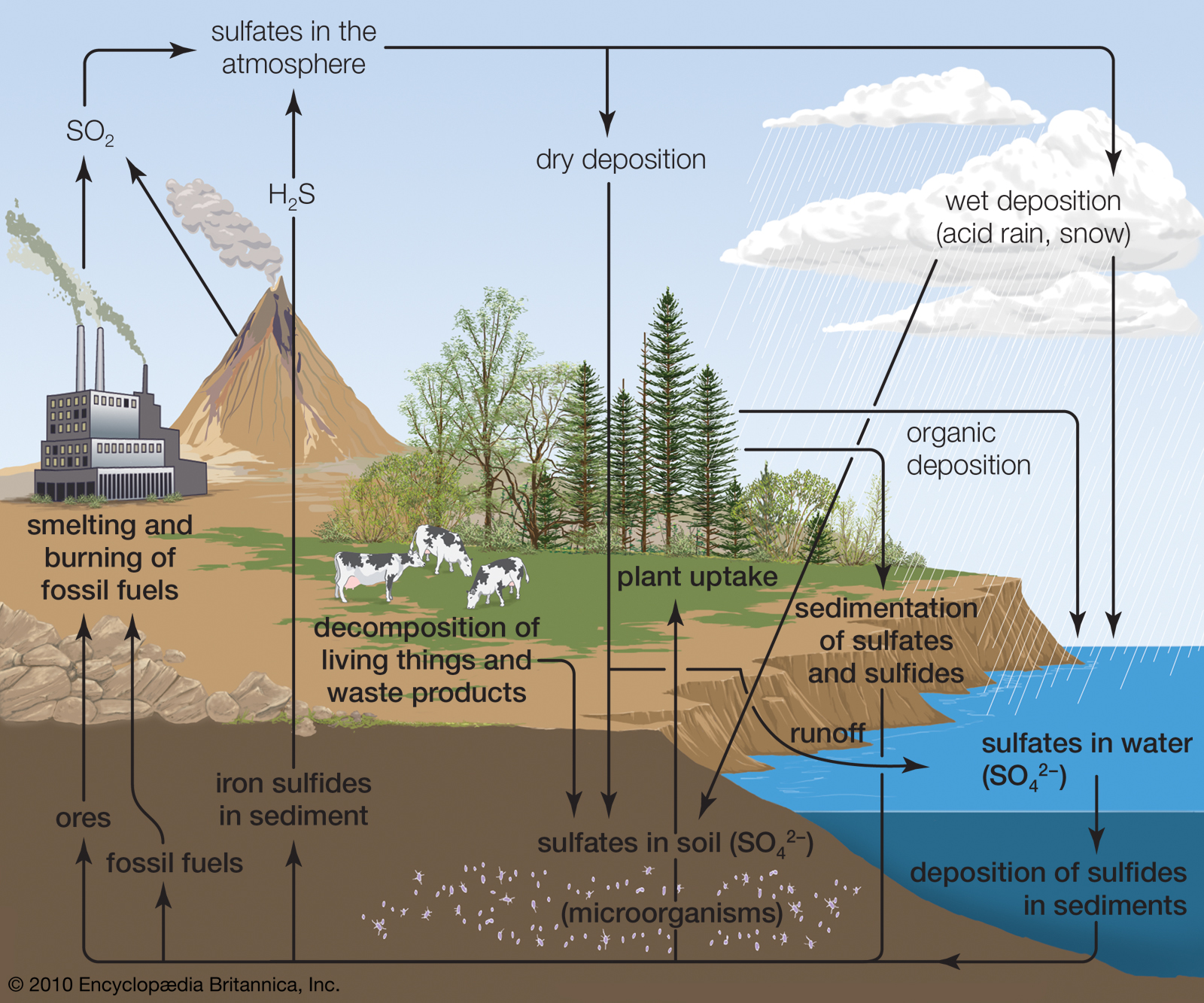
منابع عمده گوگرد ساز شامل سنگهای رسوبی است که گاز سولفید هیدروژن آزاد می کند و منابع انسانی مانند ذوب و احتراق سوخت فسیلی که هر دو دی اکسید گوگرد را در جو آزاد می کنند.
اسید سولفوریک یک اسید بسیار قوی است. در محلول های آبی کاملا یونیزه می شود و یون های هیدرونیوم (+H3O) و یون های سولفات هیدروژن (–SOH4) را تشکیل می دهد.
در محلول های رقیق یون های سولفات هیدروژن نیز جدا می شوند و یون های هیدرونیوم و یون های سولفات بیشتری ایجاد می کنند (–SO42). اسید سولفوریک غلیظ علاوه بر این که یک ماده اکسید کننده است ، در دماهای بالا به راحتی واکنش می دهد ، یک ماده کم آبی قوی نیز است و به شدت با آب ترکیب می شود.
با این ظرفیت ، بسیاری از مواد آلی مانند چوب ، کاغذ یا شکر را از بین می برد و یک بقایای کربنی باقی می گذارد.
اصطلاح بخور اسید سولفوریک یا اولئوم ، به محلول های تری اکسید گوگرد در 100 درصد اسید سولفوریک اعمال می شود. این محلول ها که معمولاً حاوی 20 ، 40 یا 65 درصد تری اکسید گوگرد هستند ، برای تهیه مواد شیمیایی آلی استفاده می شود.

